福島医学雑誌 第51巻第1 号 2001 心臓血管外科における私のアプローチ 最終講義 平成12 年3 月6 日 星野 俊一
星野 俊一
福島県立医科大学医学部 心臓血管外科講座
平成元年(1989)、福島県立医科大学に心臓血管外科が誕生し初代教授に任ぜられた。爾来11年教育、研究、診療に教室が一丸となって情熱をもってあたってきた。最終講義にあたりこれまでとりくんできた研究テーマのうちで、高度先進医療として厚生省より承認された補助人工心臓療法、レーザー血管形成術、血管内超音波による診断法および血管内視鏡の4つの研究テーマについて講義を行い、次いで最近心臓血管外科におけるトピックスのうちで、低侵襲治療の代表ともいうべきステントグラフト内挿術について言及する。
1.補助人工心臓
補助人工心臓療法は平成5年(1993年)2月厚生省より承認されたが、本学において始じめて承認された高度先進医療で、その経過を表1に示す。
| 1992.07.30 | 高度先進医療審議委員会(院内機関)において、高度先進医療として承認され、学内での研究推進を図ることとされた |
| 1992.09.09 | 高度先進医療の承認申請(厚生大臣宛) 特定承認保険医療機関及び特定承認療養取扱機関の承認申請(知事宛) |
| 1992.12.11 | 中央社会保健医療協議会において承認 |
| 1993.01.01 | 厚生大臣から高度先進医療として承認 |
| 1993.02.01 | 知事より特定承認保険医療機関及び特定承認 療養取扱機関として承認 |
種々の薬物によっても治療困難な重症心不全に対しては何らかの機械的心補助が必要となる。大動脈内バルーンパンピング(IABP)はそのような症例に対し、極めて有効な治療法として臨床応用され、現在では経皮的挿入可能なカテーテルが次々と開発され、内科・外科を問わず、日常的な治療法として広く普及している。しかしながら、心不全が更に高度となり、圧補助が主体のIABPのみでは不充分な効果しか得られない場合には強力な容量補助が必要となる。
このような極めて治療困難な重症心不全に対する切り札として登場してきたのが補助人工心臓(図1)である。心不全の原因が左心室にある場合には左心補助人工心臓(LVAD)を、右心室にある場合には右心補助人工心臓(RVAD)を使用することになるが、両心室の機能不全が考えられる場合にはそれぞれの心室の代用となる2個の人工心臓を用いた両心補助人工心臓(BVAD)を使用することもある。虚血性心疾患や弁膜疾患などの場合は通常は左心不全が主であることが多いため、多くの場合は左心補助人工心臓の適応ということになる。
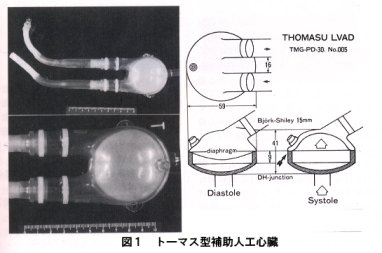
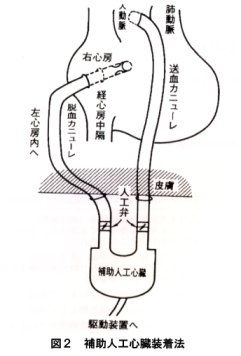
教室では1980年以来、臨床使用可能な人工心臓の研究開発を行ってきたが、補助人エ心臓に関しても動物実験を重ねて来た。そして1986年には左心補助人工心臓の臨床第1例を行い、以来、現在まで10例に左心補助人工心臓を適用した(図2)。
10例の補助様式はいずれも左心補助(LVAD)であり、急性心筋梗塞後の心原性ショックに適用した1例を除き他の9例は,いずれも開心術後の人工心肺離脱困難例に対しての使用であった。これら9例を疾患別にみると急性心筋梗塞後の中隔穿孔(5例)、心筋梗塞後の左心室瘤(2例)、弁膜症(2例)であった。LVADの使用期間は1.5時間から13 日17時間で平均4日であった。
LVADを離脱できたのは6例(離脱率60%)で、1年以上の生存例は4例(生存率40%)であった。弁膜症に比し虚血性心疾患の予後は良好であり、LVAD離脱例、生存例はいずれも虚血性心疾患に対しての適用であった。急性心筋梗塞後の心原性ショック例への適用ではLVADを10日間使用したが、心機能の回復が得られず死亡した。また、LVADを13日17時間使用した心室中隔穿孔症例は最長の使用であったが、LVADは離脱できたものの、呼吸不全が遷延し、感染から多臓器不全(MOF)が進行し救命することはできなかった。生存4例中1例2年後に仮性上行大動脈瘤、大動脈弁閉鎖不全を発症し、手術を行なったが救命できなかった。他の3例は社会復帰した。
従来の方法では救命不可能と思われた重症心不全患者に補助人工心臓を適用し40% に生存例を得たことは本法の有用性を評価しうる結果とも言えるが、死亡例の中には右心不全、感染、MOFなどが原因となった症例もあり、これらの管理に工夫を加えることにより成績は更に向上するものと考えられた。
2.閉塞性動脈硬化症に対するレーザー血管 形成術の適応
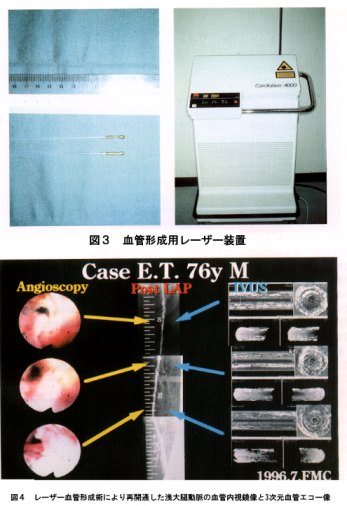
レーザー血管形成術は外科的血管再建に比し低侵襲性で、閉塞性動脈硬化症の血行再建に適応される方法であり、重篤な併存疾患を有する症例や高齢者の血行再建をより安全に施行できる有効な方法と認められ、平成5年(1993年)12月承認された。
閉塞性動脈硬化症に対する血行再建には、現在以下の5つの方法が行われている。
①外科的血行再建
②薬剤による血栓溶解
③バルーンによる血管形成
④レーザーによる血管形成
⑤アスレクトミー
従来は、①、②および③にて治療されてきた。①のバイパス手術や血栓内膜剔除術などの外科的血行再建は安定した成績を示す確立された治療方法であるが、患者に与える侵襲はやや大であり、より侵襲の少ない治癒方法として②および③が研究、臨床応用されてきた。③の狭くなった冠状動脈を拡げるバルーンを用いる方法には、再狭窄の発生の問題があり、また血管狭窄のみを対象とするもので閉塞例には適応できない。
この欠点を解消するため④のレーザーを用いた(図3)血管形成が開発された。本法は、カテーテルを用いるため大ががりな手術によらないで完全閉塞を呈する閉塞性動脈硬化症に対して、血行を再開通させうる方法であり、動脈の狭窄ないし閉塞を拡張するだけの③の方法と異なり、レーザーにより狭窄ないし閉塞を焼灼する方法である(図4)。遠隔期における再狭窄の発生も少ないと期待される。
⑤のアスレクトミーはカッターで動脈硬化部位を削る方法であるが、完全閉塞に対しては本法との併用なしには適応されない。
3.血管内超音波による診断
血管内超音波装置の超小型探触子を装着したカテーテルを血管内に挿入し、超音波を照射して血管の断層像を画像し立体的に3層構造を把握する先進性が認められ、平成7年(1995年)7月に高度先進医療として承認された。
動脈硬化病変に対する診断および評価に血管造影は不可欠な検査法であり、gold standardとされてきた。しかし、本法は造影剤で満たされた内腔のシルエット像であること、内膜肥厚やplaqueを直接観察したものではないこと、狭窄の定量化は隣接した血管径に対する%表示であり誤差の生じやすい要因となることなどの欠点が問題となってきている。
そこで近年、血管造影の欠点を補うべく欧米を中心にIVUSの研究が急速に進み、わが国も含め冠動脈病変を中心にその臨床応用が進み、最近では末梢血管に対しても応用されてきており、教室でも1994年よりendovascular surgery に対し積極的に応用している。
現時点では、IVUSの利点として以下の3点が考えられる。
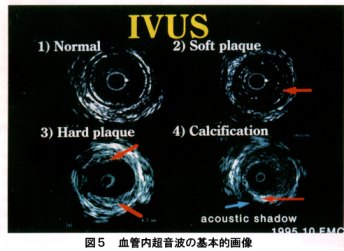
まず第一にIVUSは直接血管内腔から観察し、血管壁横断画像を描出し得ることであり、血管の形態とその内部構造が評価し得ることである。末梢血管のような弾性血管は、IVUS上、内腔から高輝度、低輝度、高輝度の三層構造として描出され、ほぼ内膜、中膜、外膜に相当すると報告されている 。また、アテロームの性状により脂肪成分を多く含むものは低輝度に(soft plaque)、繊維成分を多く含むものは高輝度に(hard plaque)、石灰化病変は外方に音響陰影を伴う高輝度像(acoustic shadow)として描出され、その組織学的性状評価も可能である(図5)。また前述した三次元構築IVUSの出現は、さらなる詳細な観察を可能にするものと考えられる。
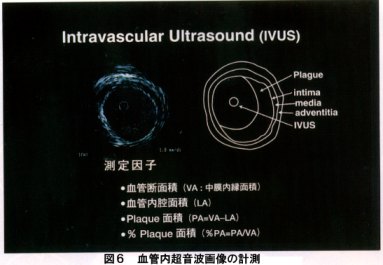
第二に血管径および面積などの計測評価(図6)が可能であることが挙げられる。IVUSによる測定結果より従来の血管造影による残存狭窄率によるend pointの評価では、かなりの残存するplaqueを見逃す危険性が示唆された。つまり、従来から教室で報告してきた血管造影上0%を目指したendovascular surgery が必要であることが裏づけられる結果が得られた。
第三にendovascular surgeryにおける適切なdeviceの選択である。現在この分野におけるdeviceの進歩はめざましいものがあり、balloon、laser、atherectomy、rotablator、stentなど、multimodalityの時代といっても過言ではない。しかし、それぞれに長所短所が存在し、病変による選択が成績向上には重要であると考えられる。IVUSは前述したごとく病変のmorphologyをほぼ正確に判断し得るため、従来の血管造影法に比し、病変に応じた適切なdeviceの選択が可能になり得ることが示唆された。特にatherectomy catheter は、病変部をカッターで切除するという特徴を有するdeviceであり、その切除部位、深達度を評価するにはIVUSは最も良い方法と考えられた。
今後のIVUSにおける展望として、カテーテルの屈曲性および径の改良、カテーテルの前方観察およびカラーフロー表示、三次元構築画像、種々のEndovascular deviceとの一体化、システムのcostdownなど、本法の発展にはまだまだ多くの問題があり、今後の研究、開発により克服されるものと期待する。
4.血管内視鏡検査
血管内視鏡検査は血管内腔を内視鏡を用いて直接観察するもので糖度の高い情報と従来なしえなかった治療が可能となるメリットを有し、カテーテルインターベンションや外科手術に用いられることより先進性が認められ、平成8年(1996年)7月に承認された。
心臓血管領域における内視鏡は、1924年Cutlerらが、僧帽弁狭窄症例に応用したことに始まり、その後多くの開発及び改良が加えられ、現在では冠動脈及び末梢動脈の診断、治療に血管造影とともにその有用性が確認されてきている。
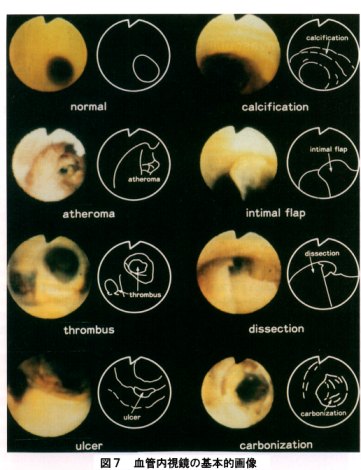
血管内視鏡は、血管造影の平面的な評価ではなく、3次元的に病変をとらえることができ、さらにその色調を把握できることから病変部の性状診断も可能になった(図7)。従来の血管造影では長区間の完全閉塞病変と診断されていた症例の中には、血管内視鏡的には分節的閉塞病変である症例も存在し、血管造影のみでは診断し得ない知見や、内膜剥離、壁在血栓及び石炭沈着など血管造影では判断し得ない血管内膜の病変を直接に観察し得る利点がある。さらに血管内視鏡はリアルタイムに病変部を観察し得ることからレーザー血管形成術(LAP)を中心とするendovascular surgeryの術式の選択、合併症にも直ちに対応しうる有用性がある。
しかしながら、現時点では血管内視鏡には今後改良しなければならない問題も数多く残されている。1)血液排除法、2)焦点深度の設定、3)色調固定、4)病変の定量化、5)血管内腔面より外側の情報は得られない、6)血管の全体像を把握できない、7)屈曲蛇行した血管、高度狭窄、閉塞病変の末梢側の観察はできないなどがあげられる。中でも診断の精度をたかめるためには、観察率をいかに高めるかは課題といえよう。教室の結果においても、内視鏡による観察が83%では可能であったが、poor(観察不可能)であったが17%存在した。poor例はすべて腸骨動脈領域であったことから、さらにflexibleな血管内視鏡、血流遮断法の工夫が必要と考えている。血管内規鏡は内膜病変のみ評価が可能であり、血管の全体像、特に中膜、外膜の病変を評価するためには、血管内エコーとの組み合わせが望まれるところである。
5.ステントグラフト内挿術
(Transluminally Placed Endovascular Endovascular Graft,TPEG)
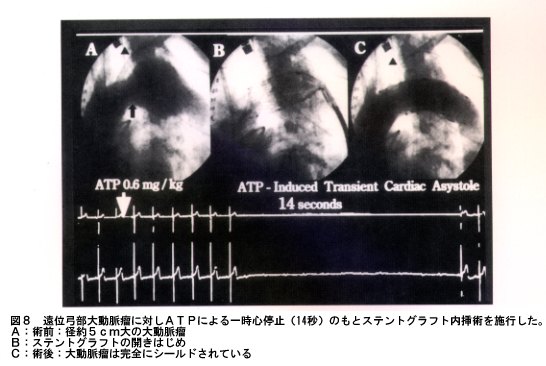
1991年JC Parodi(アルゼンチン)、次いで1994年MD Dake(アメリカ)が腹部大動脈瘤、胸部大動脈瘤に対してステントグラフト内挿術を大動脈瘤治療に応用した報告は、外科医にとって、これまでの大動脈瘤治療の概念を打ち壊すショッキングなものであった。実際の臨床においてステントグラフト内挿術を経験すると、胸部大動脈瘤であれ、胸部大動脈瘤であれ、年齢・リスクファクターの有無・瘤の大きさなどに無関係に、ほぼ術翌日には経口摂取および離床が可能であり、極めて低侵襲性治療であることを実感する。遠位弓部大動脈瘤に対するステントグラフト内挿術を図8に示す。
大動脈瘤手術の基本である大動脈瘤置換術では、人工血管は大動脈壁と縫合糸によって縫合され固定される。しかしステントグラフト留置では中枢側、末梢側ともに大動脈壁に圧着し、固定する方式である。ステントグラフトの口径を大動脈口径の10~20%大のものを使用し、大動脈内壁より外圧をかけて瘤着させる。このため圧着が過度となれば大動脈壁の損傷をきたし、破裂に至ることもある。また不十分であればグラフト移動やendoleakの原因をつくることになる。どの程度のステントグラフトサイズを選択するか、自己拡張タイプにしても、バルーン拡張タイプにしても、適正な拡張圧の基準が必要である。
ステントグラフトの固定は吻合法によるものでないので、ステントグラフト留置後ステントグラフト端が新生内膜によって被覆されることによって固定は確実となる。したがって、ステントグラフト内に形成される新生内膜との適合性に優れたものでなければならない。動脈硬化性病変の進んだ大動脈内膜とステントグラフトの圧着による治癒過程は不明であり今後の問題である。
ステントグラフトの耐久性についても未知の問題が多い。ステントグラフトが長期に亘り大動脈圧を受け、さらに拍動流にさらされた際のステントの破損、graf fatigueは遠隔期における重大な問題であり、耐久性に優れたステントグラフトの開発は必要である。
1896年ルードヴィッヒ・レーンが初めて行った心臓創の縫合、1912年アレキシス・カレルがノーベル賞を受賞した血管吻合の確立以来、20世紀における心臓血管外科の発展はめざましく、まさに激動の世紀であった。その渦中にあって共に精一杯の努力をなし、苦楽を共にした教室員の諸氏に敬意と謝意を表し稿を閉じる。